Research
私たちは、タンパク質分子構造の造形美に魅かれて研究を行っています。
生物が進化の過程で作り出した様々なタンパク質の形態形成や機能の分子論的な基盤を調べ、
そこから学んだ知識を生かして有用な人工タンパク質を設計すること夢見ています。
参考までに、現在、行われている研究をいくつか紹介します。
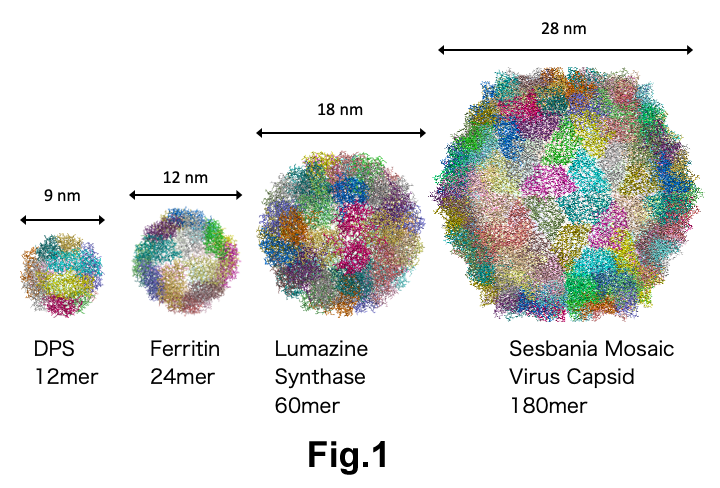
ボール状タンパク質の構造形成機構
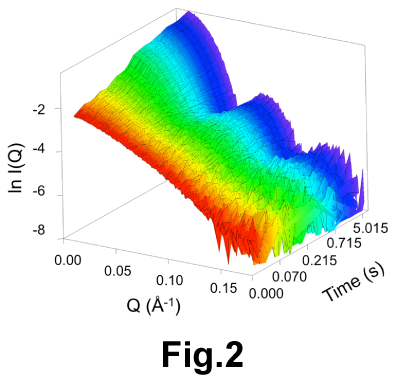
生体内には図1のようなボールのように球形で内部が空洞のタンパク質が多数存在します。 フェリチンはボールのように球状で内部の空洞に鉄を貯蔵するタンパク質です。 フェリチンは24量体ですが、フェリチンと同じサブユニット構造(4-helix bundle)を持ち、 12量体で球状構造をとるDNA結合タンパク質Dpsが存在します。ルマジン合成酵素は60量体、 ウイルスは180量体などタンパク質の数が増えるとサイズも大きくなります。 我々の研究室ではフェリチンがどのようにして集まって球状になるのかを調べました。 Stopped-flowという溶液混合の500分の1秒後からの変化を追跡できる装置と放射光施設 SPring-8の高輝度X線を用いて、反応の全体像を観測することに成功しました(図2)。
フェリチンの分子進化
フェリチンはほとんどの生物種が持つタンパク質ですが、生物種ごとに少しずつ性質が異なります。 細菌や古細菌のフェリチンは鉄酸化活性を持つ1種類のタンパク質で出来ていて内部の空洞に 鉄をリン酸鉄として蓄えます。植物は複数種類のタンパク質で出来ている場合もありますが、やはり 鉄をリン酸鉄として蓄えます。これに対して脊椎動物は細菌や植物と同じような鉄酸化活性を持つ タンパク質と鉄酸化活性のないタンパク質の混合物として作られていて、鉄をリン酸をほとんど 含まない形で貯蔵します。フェリチンが進化の過程でどのように変化したのか調べています。
タンパク質の設計:フェリチンのドラッグ・デリバリー・システムへの応用
ドラッグ・デリバリー・システム(DDS)とは薬物を目的の部位に届ける技術です。フェリチンは 大きな空洞を持ちますので内部に抗癌剤などを搭載して癌細胞に届けるのに役立つのではないかと 考えられています。もともとヒト・フェリチンは血液中に存在するので免疫原性がない、トランスフェリン 受容体に結合して細胞内に取り込まれるなど、いくつかの利点を持っていますが、薬剤を搭載する方法に 改良するべき点が多くあります。フェリチンのアミノ酸配列の一部を変えて薬剤を搭載しやすいように 改良する研究をしています。
アミノ酸配列と立体構造の関係を解明
タンパク質の構造中には、αへリックスやβシートと呼ばれる二次構造が存在します。 αヘリックスは螺旋状の構造であり、βシートはまっすぐ伸びた状態であるβストランドが何本か並んだ構造です。 βシートはαへリックスに比べて、構造の種類が多いことが知られています。 また、アミノ酸配列上遠く離れた場所同士が相互作用していることも複雑さの原因になっています。 しかし、ほとんどのβストランドは右ねじれを持っているという共通性があり、古くからねじれの原因に関する研究がなされてきました(図3の左側)。 一方、ねじれていないβシートもいくつか見つかっていますが、こちらはほとんど注目されていませんでした(図3の右側)。 またβストランドはねじれているだけではなく、曲がっているものも多く存在していますが、これについても調査された例はありませんでした。 そこで、本研究室では、どのような場合にねじれるのかまた曲がるのかについて既存のタンパク質の構造を詳細に調査し、 現在までにまっすぐ伸びたβストランドとねじれているβストランド、さらに曲がっているβストランドにおいてアミノ酸の組成が異なっていることを明らかにしています。 タンパク質のデザインや予測のためにさらに具体的にアミノ酸配列と立体構造との関係性について研究を進めています。
アミノ酸配列と立体構造の関係を解明
体内の代謝の多くはタンパク質同士の相互作用、複合体形成により調節されています。 しかしながら、どのタンパク質とどのタンパク質が相互作用するかはなかなか予測できないのが現状です。 近年、多くのタンパク質の複合体構造が明らかにされ、それらのデータを取得できるようになっていますが、 情報量が多く目的の構造データにたどりつくまでにかなりの時間を要するようになってきました。 そこで本研究室では、複合体の情報を見やすくし、目的の構造データに素早くアクセスできるようにしたデータベースの公開を行っています(図4)。 さらにタンパク質同士の相互作用の仕組みを明らかにするために役立つ新たな機能の開発を進めています。